Ван-дер-Ваальса рівняння
Ван-дер-В а Альс зрівняні е ня, одне з перших рівнянь стану реального газу, запропоноване голландським фізиком Я. Д. Ван-дер-Ваальса (1873):
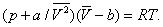
Тут: р - тиск газу; Т - його температура; 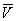 - обсяг одного благаючи речовини; R - універсальна газова постійна ; а й b - константи, що враховують відхилення властивостей реального газу від властивостей ідеального. член
- обсяг одного благаючи речовини; R - універсальна газова постійна ; а й b - константи, що враховують відхилення властивостей реального газу від властивостей ідеального. член 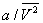 , Що має розмірність тиску, враховує тяжіння між молекулами газу за рахунок ван дер Ваальсових сил (див. міжмолекулярної взаємодії ). Константа b є поправкою на власний об'єм молекул газу і враховує відштовхування молекул на близьких відстанях. Константи а і b зазвичай визначаються з експериментальних даних. при великих
, Що має розмірність тиску, враховує тяжіння між молекулами газу за рахунок ван дер Ваальсових сил (див. міжмолекулярної взаємодії ). Константа b є поправкою на власний об'єм молекул газу і враховує відштовхування молекул на близьких відстанях. Константи а і b зазвичай визначаються з експериментальних даних. при великих 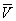 можна знехтувати обома поправками і В. у. переходить в рівняння стану ідеального газу (див. Клапейрона рівняння ).
можна знехтувати обома поправками і В. у. переходить в рівняння стану ідеального газу (див. Клапейрона рівняння ).
На рис. зображено сімейство ізотерм (кривих залежності р від 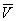 при постійній температурі), розрахованих по Ст в. Це рівняння, кубічне щодо
при постійній температурі), розрахованих по Ст в. Це рівняння, кубічне щодо 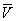 , Має три кореня. При низьких температурах всі три корені - дійсні, а вище певної температури Тк, званої критичної, залишається лише один дійсний корінь. Фізично це означає, що при Т> Тк речовина може перебувати лише в одному (газоподібному) стані, а нижче Тк - в трьох станах (двох стабільних - рідкому
, Має три кореня. При низьких температурах всі три корені - дійсні, а вище певної температури Тк, званої критичної, залишається лише один дійсний корінь. Фізично це означає, що при Т> Тк речовина може перебувати лише в одному (газоподібному) стані, а нижче Тк - в трьох станах (двох стабільних - рідкому 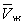 і газоподібному
і газоподібному 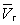 - і одному нестабільному). Графічно це виражається так: при Т <Т к ізотерма має три точки перетину з прямою ac, паралельної осі обсягів. Точки прямий ac відповідають рівновазі рідини і її насиченої пари. В умовах рівноваги, наприклад в стані, відповідному точці b, відносні кількості рідини і пара визначаються ставленням відрізків bc / ba ( «правило моментів»). Рівноваги фаз при певній температурі відповідають тиск насиченої пари РНП і інтервал обсягів від
- і одному нестабільному). Графічно це виражається так: при Т <Т к ізотерма має три точки перетину з прямою ac, паралельної осі обсягів. Точки прямий ac відповідають рівновазі рідини і її насиченої пари. В умовах рівноваги, наприклад в стані, відповідному точці b, відносні кількості рідини і пара визначаються ставленням відрізків bc / ba ( «правило моментів»). Рівноваги фаз при певній температурі відповідають тиск насиченої пари РНП і інтервал обсягів від 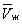 до
до 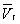 . При більш низькому тиску (правіше
. При більш низькому тиску (правіше  ) Ізотерма характеризує властивості газу. Ліва, майже вертикальна частина ізотерми відображає дуже малу стисливість рідини. Ділянки ad і ес відносяться відповідно до перегрітої рідини і переохолодження пару ( метастабільні стани ). Ділянка de фізично неможливий, так як тут відбувається збільшення обсягу при збільшенні тиску. Сукупність точок а, a ', а »... і з, c', з» ... визначає криву, звану бінодалью, яка окреслює область спільного існування газу і рідини. У критичній точці До температура, тиск і обсяг (Тк, рк,
) Ізотерма характеризує властивості газу. Ліва, майже вертикальна частина ізотерми відображає дуже малу стисливість рідини. Ділянки ad і ес відносяться відповідно до перегрітої рідини і переохолодження пару ( метастабільні стани ). Ділянка de фізично неможливий, так як тут відбувається збільшення обсягу при збільшенні тиску. Сукупність точок а, a ', а »... і з, c', з» ... визначає криву, звану бінодалью, яка окреслює область спільного існування газу і рідини. У критичній точці До температура, тиск і обсяг (Тк, рк, 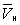 ) Мають значення, характерні для кожної речовини. Однак, якщо в Ст в. ввести відносні величини: Т / Тк, Р / рк і
) Мають значення, характерні для кожної речовини. Однак, якщо в Ст в. ввести відносні величини: Т / Тк, Р / рк і 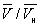 , То можна отримати так зване наведене В. у., Яке є універсальним, тобто не залежить від індивідуальних властивостей речовини.
, То можна отримати так зване наведене В. у., Яке є універсальним, тобто не залежить від індивідуальних властивостей речовини.
Літ .: Штрауф Е. А., Молекулярна фізика, Л. - М., 1949; 3оммерфельд А., Термодинаміка і статистична фізика, пер. з нім., М., 1955: Вукаловіч М. П. і Новіков І. І., Рівняння стану реальних газів, М. - Л., 1948.
А. А. Лопаткін.

Діаграма стану речовини в координатах об'єм - тиск ( 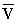 , P): Т1, Т2, Т3, Тк - ізотерми, розраховані за рівнянням Ван-дер-Ваальса; К - критична точка. Лінія dke ( «спінодаль») окреслює область нестійких станів.
, P): Т1, Т2, Т3, Тк - ізотерми, розраховані за рівнянням Ван-дер-Ваальса; К - критична точка. Лінія dke ( «спінодаль») окреслює область нестійких станів.