Рівняння хімічних реакцій. Закон збереження маси речовин в хімічних реакціях »Народна Освіта
Закон збереження маси
Всі хімічні перетворення зручно описувати за допомогою хімічних формул і рівнянь реакцій. Процес горіння вугілля можна описати такою схемою:

Цю схематичну запис називають рівнянням хімічної реакції. У лівій частині рівняння записано один атом Карбону і одна молекула кисню, яка складається з двох атомів Оксигену. У правій частині рівняння записана одна молекула вуглекислого газу (карбон (ГУ) оксиду), яка складається з одного атома Карбону і двох атомів Оксигену.

Число атомів кожного хімічного елемента в обох частинах рівняння однаково. Для того щоб підкреслити рівне число атомів всіх елементів, в даному записі стрілку можна замінити на знак рівності:
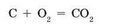
Рівняння хімічної реакції є відображенням закону збереження маси речовин в хімічних реакціях.
Маса речовин, які вступили в хімічну реакцію, дорівнює масі речовин, які утворилися в результаті реакції.
Цей закон був відкритий М. В. Ломоносовим в 1748 році і, незалежно від нього, А. Лавуазьє в 1789 році, а тому цей закон називають також законом Ломоносова-Лавуазьє.
В результаті хімічних реакцій одні речовини перетворюються в інші: атоми, з яких складаються вихідні речовини, не зникають, не народжуються і не перетворюються з одного виду в інший, а тільки перегруповуються, утворюючи молекули нових речовин.
Сьогодні це твердження здається очевидним, проте в XVII в. спостереження деяких учених суперечили йому. Наприклад, спирт при горінні поступово втрачає масу і, нарешті, зникає. Якщо залізна пластинка лежить на повітрі, вона поступово іржавіє і її маса при цьому збільшується. Як це пояснити? Пояснення цим фактам знайшли тільки після проведення експериментів з ретельним зважуванням вихідних речовин і продуктів реакцій.
Доведемо, що під час горіння закон збереження маси виконується. Горіння свічки - це хімічна реакція, яка відбувається з утворенням вуглекислого газу і води (у вигляді водяної пари). Продукти реакції (вуглекислий газ і водяну пару) - це газоподібні речовини, які випаровуються, і тому здається, що речовина зникає. Якщо реакцію проводити в закритій посудині, то продуктам реакції не буде куди зникати.
На одну чашу терезів помістимо горюча речовина в герметично закритій ємності, заповненої киснем (рис. 86). Врівноважити терези і підпалимо. Речовина деякий час горить, а потім, коли витратиться кисень, горіння припиняється. Під час горіння рівновагу терезів зберігається. Таким чином, маса колби з вихідними речовинами дорівнює масі колби з продуктами реакції.
У разі іржавіння заліза атоми Феррум реагують з киснем і водою з навколишнього повітря. В цьому випадку утворюється іржа, маса якої більше, ніж маса вихідного заліза, тому здається, що речовина виникає нізвідки.
Проведемо подібний досвід в герметичній колбі (рис. 87а). Помістимо зразок металу в колбу, закриємо її корком з запаяної газовідвідною трубкою і нагріємо. Після прожарювання метал змінює свій колір, так як він перетворився в оксид (рис. 876). Щоб довести, що частина повітря витрачено на реакцію з металом, опустимо газовідвідну трубку в ємність з водою і відкриємо кінець трубки. Оскільки частина повітря з'єдналася з металом, то в колбі виникло вільний простір, який через трубку заповнює вода (рис. 87е).
Видатний російський вчений. Навчався в слова-но-греко-латинської академії, в Києво-Могилянській академії, Петербурзькому університеті, в університеті Гамбурга. Ломоносов був одним з найосвіченіших людей Росії того часу. Заслуговують на увагу його праці не тільки в області хімії, а й у мінералогії, географії, металургії, фізиці, історії, поезії, образотворчому мистецтві. Відкрив закон збереження маси, створив першу в Росії хімічну лабораторію. За результатами спостережень сонячного затемнення встановив існування атмосфери на Венері. За його ініціативи було відкрито Московський університет, який сьогодні носить його ім'я.
Рівняння хімічних реакцій складаються з урахуванням закону збереження маси. Розглянемо, як складаються рівняння реакцій утворення бінарних сполук з простих речовин.
Приклад 1. Складемо рівняння реакції утворення метану СН4 - основного компонента природного газу. Метан складається з атомів Карбону і Гідрогену. Таким чином, для його отримання необхідні прості речовини, одне з яких складається з атомів Карбону (вугілля С), а інше - з атомів Гідрогену (водень Н2).
У лівій частині записуємо вихідні речовини (реагенти) С і Н2, а в правій - продукт реакції СН4:
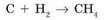
Але цей запис ще не є рівнянням реакції - це схема реакції. Для того щоб вона перетворилася в рівняння, необхідно зрівняти число атомів кожного елемента в лівій і правій частинах. Для цього необхідно підібрати коефіцієнти - цифри перед хімічними формулами, які вказують число молекул (атомів). Як видно, в лівій і правій частинах схеми по одному атому Карбону, але в лівій частині два атоми Гідрогену (одна молекула водню), а в правій - чотири атома (в складі однієї молекули метану). Це суперечить закону збереження маси. Щоб це виправити, перед формулою водню в лівій частині рівняння потрібно поставити коефіцієнт 2:
Тепер в обох частинах рівняння число атомів Гідрогену і Карбону однаково, тому стрілку між реагентами і продуктами в рівнянні можна замінити знаком рівності:
Приклад 2. Розглянемо реакцію горіння метану. Горіння - це взаємодія з киснем 02. При горінні метану утворюються вуглекислий газ С02 і вода Н20.
Запишемо схему реакції:
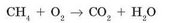
Тепер необхідно зрівняти число атомів кожного хімічного елемента, т. Е. Підібрати коефіцієнти. Почнемо з атомів Карбону:
в обох частинах рівняння їх по одному. Потім підрахуємо атоми Гідрогену: в лівій частині чотири атома, а в правій - два. Щоб зрівняти їх число, потрібно перед формулою води поставити коефіцієнт 2:
Залишилося зрівняти число атомів Оксигену (зазвичай Оксиген зрівнюють останнім). У лівій частині рівняння два атома Оксигену в молекулі 02, а в правій - чотири (два атома в складі молекули вуглекислого газу С02 і два атома в складі двох молекул води Н20). Таким чином, в лівій частині рівняння перед формулою кисню необхідно поставити коефіцієнт 2:
Тепер число атомів всіх елементів однаково, отже, коефіцієнти підібрані правильно.
Підбираючи коефіцієнти в рівнянні реакції, необхідно пам'ятати наступні правила:
• коефіцієнт показує число молекул, окремих атомів або
формульних одиниць в рівнянні реакції;
• коефіцієнт ставиться тільки перед хімічною формулою;
• коефіцієнт відноситься до всіх атомам, з яких складається
молекула, перед якою він стоїть, наприклад:
запис 2Н20 означає дві молекули води, в яких міститься 4 атоми Гідрогену (по два в кожній молекулі) і 2 атома Оксигену (по одному в кожній молекулі);
• коефіцієнт 1, як і індекс 1, що не записується;
• індекс показує число атомів елемента (або груп атомів) в складі молекули, а коефіцієнт - число молекул, наприклад:
Н - один атом Гідрогену;
2Н - два атоми Гідрогену;
Н2 - одна молекула водню, що складається з двох атомів Гідрогену;
2Н2 - дві молекули водню, кожна з яких складається з двох атомів Гідрогену.
Записи 4Н і 2Н2 нерівнозначні. Хоча в них і записано однакове число атомів Гідрогену, але перший запис означає чотири окремі атоми Гідрогену, а друга - дві молекули водню.
У рівняннях реакцій часто вказують умови протікання реакцій або виділення газу і осаду. Так, якщо з розчину виділяється газоподібна речовина, то поруч з його формулою ставлять стрілку, спрямовану вгору: з газів або рідин утворюється
нерозчинний речовина, то поруч з його формулою ставлять стрілку, спрямовану вниз: І.
висновки:
1. Маси речовин, що вступають в реакцію, рівні масі освічених речовин, про що свідчить закон збереження маси в хімічних реакціях. Цей закон заснований на тому, що атоми в хімічних реакціях не зникають, а просто переходять з одних речовин до складу інших. За допомогою хімічних символів і знаків закон збереження маси відображають рівнянням хімічної реакції.
2. При складанні рівнянь хімічних реакцій необхідно дотримуватися умова, що число атомів всіх елементів в лівій і правій частинах рівняння має бути однаковим. Для цього перед хімічними формулами пишуть коефіцієнти, які позначають число молекул, окремих атомів або формульних одиниць.
Контрольні питання
1. Сформулюйте закон збереження маси речовин і обґрунтуйте його з позиції понять про атоми і молекулах.
2. Чому при горінні свічки її маса поступово зменшується? Чи не суперечить це закону збереження маси?
3. Який запис називають рівнянням хімічної реакції?
4. Яке значення коефіцієнтів в рівнянні реакції та індексів в хімічній формулі? У чому полягає відмінність між коефіцієнтом і індексом?
Завдання для засвоєння матеріалу
1. Поясніть, що означають записи:
а) 2Н, О, 4Fe, 3Са, 5 ^ б) 02, 502, 60, 03, 203; в) 3 ^ 0, 5Н2, 2С02, 5С, 3О2.
2. Розгляньте схематичне зображення хімічної реакції утворення аміаку. Запишіть для неї рівняння, якщо синіми кульками позначені атоми Нітрогену, а червоними - Гідрогену.
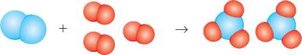
3. Підберіть коефіцієнти. Якщо потрібно, позначте виділення газу або освіту нерозчинної речовини відповідними символами.
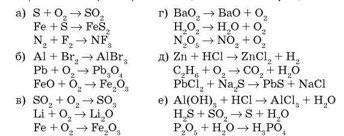
4. Складіть рівняння реакцій: а) в результаті взаємодії водню H2 і кисню 02 утворюється вода Н20; б) залізо Fe реагує з киснем і водою і покривається іржею, основною складовою якої є речовина з формулою Fe (0H) 3; в) в результаті розкладання сахарози С12Н220л утворюються вугілля C і вода Н20.
5. На малюнку 88 представлена схема хімічної реакції взаємодії літію з водою. Складіть рівняння цієї реакції.
6. На малюнку 89 (с. 121) наведено моделі речовин. Складіть рівняння реакції натрію з хлором.
7. В результаті взаємодії сірки S масою 16 г з залізом Fe утворилося 44 г ферум (М) сульфіду FeS. Обчисліть масу витраченого заліза.
8. У результаті взаємодії метану масою 8 г з киснем масою 32 г утворився вуглекислий газ масою 22 г. Обчисліть, яка маса води утворилася в результаті цієї реакції.
9. Складіть рівняння реакцій утворення з простих речовин наступних сполук: а) ферум (11) оксид FeO; б) аргентум (1) сульфід Ag2S; в) кальцій фосфід Ca3P2; г) алюміній оксид Al2O3; д) фосфор ^) оксид P2O5.
Це матеріал підручника Хімія 7 клас Григорович
Як це пояснити?2. Чому при горінні свічки її маса поступово зменшується?
Чи не суперечить це закону збереження маси?
3. Який запис називають рівнянням хімічної реакції?
4. Яке значення коефіцієнтів в рівнянні реакції та індексів в хімічній формулі?
У чому полягає відмінність між коефіцієнтом і індексом?