Внутрішня енергія
Внутрішня енергія функція стану системи, її енергія, яка визначається внутрішнім станом. Внутрішня енергія складається в основному з кінетичної енергії руху частинок (атомів, молекул, іонів , Електронів) і енергії взаємодії між ними (внутрішньо-і міжмолекулярної). На внутрішню енергію впливає зміна внутрішнього стану системи під дією зовнішнього поля; у внутрішню енергію входить, зокрема, енергія, пов'язана з поляризацією діелектрика в зовнішньому електричному полі і намагнічуванням парамагнетика в зовнішньому магнітному полі. Кінетична енергія системи як цілого і потенційна енергія, обумовлена просторовим розташуванням системи, у внутрішню енергію не включаються. В термодинаміки визначається лише зміна внутрішньої енергії в різних процесах. Тому внутрішню енергію задають з точністю до деякого постійного доданка, залежить від енергії, прийнятої за нуль відліку.
Внутрішня енергія U як функція стану вводиться першим початком термодинаміки , Згідно з яким різниця між теплотою Q, переданої системі, і роботою W, яку здійснюють системою, залежить тільки від початкового і кінцевого станів системи і не залежить від шляху переходу, тобто представляє зміна фунікціі стану Δ U
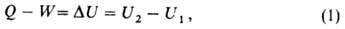
де U1 і U2 - внутрішня енергія системи в початковому і кінцевому станах відповідно. Рівняння (1) висловлює закон збереження енергії в застосуванні до термодинамічних процесів, тобто процесам, в яких відбувається передача теплоти. Для циклічного процесу, що повертає систему в початковий стан, Δ U = 0. У ізохоричний процес, тобто процесах при постійному обсязі, система не робить роботи за рахунок розширення, W = 0 і теплота, передана системі, дорівнює приросту внутрішньої енергії: Qv = Δ U. Для адиабатических процесів, коли Q = 0, Δ U = - W.
Внутрішня енергія системи як функція її ентропії S, обсягу V і числа молей mi i-того компонента являє собою термодинамічний потенціал . Це є наслідком першого і другого почав термодинаміки і виражається співвідношенням:
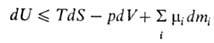
де Т - абсолютна температура, р - тиск, μi - хімічний потенціал i-того компонента. Знак рівності відноситься до рівноважним процесам, знак нерівності - до нерівноважних. Для системи з заданими значеннями S, V, mi ( закрита система в жорсткій адіабатною оболонці) внутрішня енергія при рівновазі мінімальна. Спад внутрішньої енергії в оборотних процесах при постійних V і S дорівнює максимальної корисної роботи (див. Максимальна робота реакції ).
Залежність внутрішньої енергії рівноважної системи від температури і об'єму U = f (T, V) називається калоріческой рівнянням стану . Похідна внутрішньої енергії по температурі при постійному обсязі дорівнює ізохорно теплоємності .
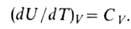
Внутрішня енергія ідеального газу від об'єму не залежить і визначається тільки температурою.
Експериментально визначають значення внутрішньої енергії речовини, що відраховується від її значення при абсолютному нулі температури. Визначення внутрішньої енергії вимагає даних про теплоємності СV (Т), теплотах фазових переходів , Про зрівняння стану. Зміна внутрішньої енергії при хімічних реакціях (зокрема, стандартна внутрішня енергія утворення речовини) визначається за даними про теплових ефекти реакцій, а також по спектральним даними. Теоретичний розрахунок внутрішньої енергії здійснюється методами статистичної термодинаміки, яка визначає внутрішню енергію як середню енергію системи в заданих умовах ізоляції (наприклад, при заданих Т, V, mi). Внутрішня енергія одноатомного ідеального газу складається із середньої енергії поступального руху молекул і середньої енергії збуджених електронних станів; для дво- і багатоатомних газів до цього значення додається також середня енергія обертання молекул і їх коливань біля положення рівноваги. Внутрішня енергія 1 моля одноатомного ідеального газу при температурах порядку сотень До становить 3RT / 2, де R - газова постійна; вона зводиться до середньої енергії поступального руху молекул. Для двоатомних газу мольное значення внутрішньої енергії - близько 5RT / 2 (сума поступального і обертального вкладів). Зазначені значення відповідають закону равнораспределенія енергії для названих видів руху і випливають із законів класичної статистичної механіки. Розрахунок коливального і електронного вкладів у внутрішню енергію, а також обертального вкладу при низьких температурах вимагає врахування квантовомеханических закономірностей. Внутрішня енергія реальних систем включає крім вкладів, що враховуються для ідеального газу, також середню енергію міжмолекулярних взаємодій .
Літ .: Ландау Л.Д., Ліфшиц Е.М., Статистична фізика, 2 вид., М., 1964; Полторак О.М., Лекції з хімічної термодинаміки, М., 1971; Карапетьянц М. X., Хімічна термодинаміка, 3 вид., М., 1975.
© Н.А.Смірнова.